初三化學,學到溶液那章,一定要理解溶解度曲線是什麼意思。
溶解度的概念是有一定條件的,首先是要在一定的溫度下,100克溶劑所能溶解的最多的溶質的質量。這裡所指的最多的溶質,是溶液達到飽和的溶質的質量。
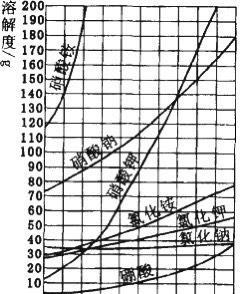 溶解度曲線圖
溶解度曲線圖我們常說的溶劑,一般是指水,但也有別的溶劑。因為隨著溫度的變化,溶解度會改變,所以溶解度概念的前提是要在一定的溫度下。舉個很簡單的例子,我們經常會泡糖水喝,當白糖溶解在水中達到飽和,不能再溶解後,我們把溫度升高,熱水又能把糖溶解了,所以,溶解度概念要有「在一定溫度下」這一前提。
大多數物質,溶解度會隨溫度的升高而增大,也就是說,溫度越高,能溶解的溶質就越多,但是也有例外的,最常見的例外就是石灰水,化學名稱氫氧化鈣,它的溶解度是隨溫度的升高而降低的。
我們常用的調味品—食鹽,化學名稱為氯化鈉,它的溶解度曲線幾乎就是一條直線,意思就是它的溶解度受溫度的影響不大,不管溫度如何邊化,溶劑能溶解的溶質基本保持一致。
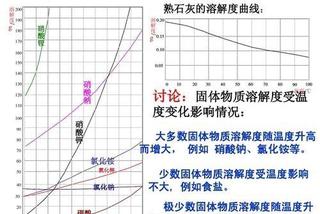 溶解度受溫度的影響
溶解度受溫度的影響所以,當幾種物質混在一起,需要把它們分離的話,根據溶解度的不同,可以用降溫結晶法把物質分離。
在中考中,這個知識點常考的形式就是給了溶解度曲線,要求曲線中一個點表示的意義,要抓住:一定溫度下這個前提條件。這個是容易題。
溶解度的概念還要理解是100克溶劑能溶解的最多的溶質,比如:在60度時,氯化鈉的溶解度是36克。它的意思是:在60度時,100克的水能溶解36克氯化鈉並達到飽和。溶解度也表示在此溫度下,溶質的質量分數最大,也就是說,在此溫度下,溶質能佔的比例最多。