一、價層電子對互斥理論( Valence Shell Electron Pair Repulsion )
1、內容:對ABn型的分子或離子,中心原子A價層電子對(包括成鍵σ鍵電子對和未成鍵的孤對電子對)之間由於存在排斥力,將使分子的幾何構型總是採取電子對相互排斥最小的那種構型,以使彼此之間斥力最小,分子體系能量最低,最穩定。
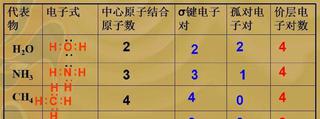 價層電子對互斥理論求法
價層電子對互斥理論求法價層電子對數分別為:2、3、4,電子對之間的互斥,排斥力最小。
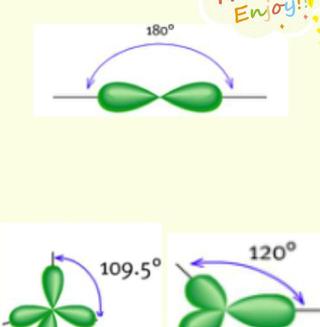 價層電子對之間的互斥圖
價層電子對之間的互斥圖2、成鍵σ鍵電子對和未成鍵的孤對電子對
價層電子對數=δ鍵個數+中心原子上的孤對電子對個數;
δ鍵電子對數 = 與中心原子結合的原子數;
中心原子上的孤電子對數 =(a-xb); a:中心原子最外層電子數,離子:±電荷數; x:與中心原子結合的原子數;
b:與中心原子結合的原子最多能接受的電子數;
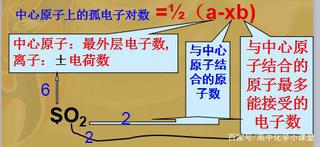 孤電子對表達式
孤電子對表達式二、確定分子構型
在價層電子對構型的基礎上,去掉孤電子對既真實原子形成的構型 。(即用VSEPR模型預測分子立體構型),中心原子的孤對電子也要佔據中心原子的空間,並與成鍵電子對互相排斥。推測分子的立體模型必須略去VSEPR模型中的孤電子對。
 用VSEPR模型預測分子立體構型列表
用VSEPR模型預測分子立體構型列表